CE认证详解-公告机构
一、公告机构介绍
产品出口欧盟需要通过CE认证,而CE认证的发证机构就是我们通常所说的公告机构-Notified Body,简称NB机构。
根据MDR法规及IVDR法规,公告机构应当经过欧盟相关部门即(MDCG)的资格认定,结果将公示在NANDO信息系统,可以详细查阅每个公告机构的信息,包括公告机构号,授权范围等。截至2023年8月18日,欧盟已批准10家负责体外诊断试剂中报资料审评的公告机构,39家负责医疗械申报资料审评的公告机构,其中有9家机构可以兼顾MDR和IVDR的审评工作。MDR法规附录规定,公告机构负责审评医疗器械/体外诊断剂相关资料,并对制造商进行质量管理体系审该等,若拟申报医疗器械/体外诊断试剂符合要求,公告机构将出具合格评定证书。制造商取得合格评定证明并准备好符合性声明和CE标识后,产品方可上市销售。
| Body type | Body Name | Country |
| NB 0044 | TÜV NORD CERT GmbH | Germany |
| NB 0050 | National Standards Authority of Ireland (NSAI) | Ireland |
| NB 0051 | IMQ ISTITUTO ITALIANO DEL MARCHIO DI QUALITÀ S.P.A. | Italy |
| NB 0123 | TÜV SÜD Product Service GmbH | Germany |
| NB 0124 | DEKRA Certification GmbH | Germany |
| NB 0197 | TÜV Rheinland LGA Products GmbH | Germany |
| NB 0297 | DQS Medizinprodukte GmbH | Germany |
| NB 0318 | CENTRO NACIONAL DE CERTIFICACION DE PRODUCTOS SANITARIOS | Spain |
| NB 0344 | DEKRA Certification B.V. | Netherlands |
| NB 0373 | ISTITUTO SUPERIORE DI SANITA' | Italy |
| NB 0425 | ICIM S.P.A. | Italy |
| NB 0426 | ITALCERT SRL | Italy |
| NB 0459 | GMED SAS | France |
| NB 0476 | KIWA CERMET ITALIA S.P.A. | Italy |
| NB 0477 | Eurofins Product Testing Italy S.r.l. | Italy |
| NB 0482 | DNV MEDCERT GmbH | Germany |
| NB 0483 | MDC MEDICAL DEVICE CERTIFICATION GMBH | Germany |
| NB 0494 | SLG PRÜF UND ZERTIFIZIERUNGS GMBH | Germany |
| NB 0537 | Eurofins Electric & Electronics Finland Oy | Finland |
| NB 0546 | CERTIQUALITY S.r.l. | Italy |
| NB 0598 ex:403 | SGS FIMKO OY | Finland |
| NB 0633 | Berlin Cert Prüf- und Zertifizierstelle für Medizinprodukte GmbH | Germany |
| NB 1023 | INSTITUT PRO TESTOVÁNI A CERTIFIKACI, a. s. (INSTITUTE FOR TESTING AND CERTIFICATION) merged with ex-NB 1390 | Czech Republic |
| NB 1282 | ENTE CERTIFICAZIONE MACCHINE SRL | Italy |
| NB 1304 | SLOVENIAN INSTITUTE OF QUALITY AND METROLOGY - SIQ | Slovenia |
| NB 1370 | BUREAU VERITAS ITALIA S.P.A. | Italy |
| NB 1434 | POLSKIE CENTRUM BADAN I CERTYFIKACJI S.A. | Poland |
| NB 1639 | SGS Belgium NV | Belgium |
| NB 1912 | Kiwa Dare B.V. | Netherlands |
| NB 1936 | TUV Rheinland Italia SRL | Italy |
| NB 2265 | 3EC International a.s. | Slovakia |
| NB 2274 | TUV NORD Polska Sp. z o.o | Poland |
| NB 2292 | UDEM Uluslararasi Belgelendirme Denetim Egitim Merkezi San. ve Tic. A.Ş. | Türkiye |
| NB 2409 | CE Certiso Orvos- és Kórháztechnikai Ellenőrző és Tanúsító Kft. | Hungary |
| NB 2460 | DNV Product Assurance AS | Norway |
| NB 2696 | UDEM Adriatic d.o.o. | Croatia |
| NB 2764 | Notice Belgelendirme, Muayene ve Denetim Hizmetleri Anonim Şirketi | Türkiye |
| NB 2797 | BSI Group The Netherlands B.V. | Netherlands |
| NB 2803 | HTCert (Health Technology Certification Ltd) | Cyprus |
| NB 2862 | Intertek Medical Notified Body AB | Sweden |
| NB 2975 | SZUTEST Konformitätsbewertungsstelle GmbH | Germany |
| NB 3022 | Scarlet NB B.V. | Netherlands |
MDR公告机构
| Body type | Body Name | Country |
| NB 0050 | National Standards Authority of Ireland (NSAI) | Ireland |
| NB 0123 | TÜV SÜD Product Service GmbH | Germany |
| NB 0124 | DEKRA Certification GmbH | Germany |
| NB 0197 | TÜV Rheinland LGA Products GmbH | Germany |
| NB 0344 | DEKRA Certification B.V. | Netherlands |
| NB 0459 | GMED SAS | France |
| NB 0483 | MDC MEDICAL DEVICE CERTIFICATION GMBH | Germany |
| NB 0537 | Eurofins Electric & Electronics Finland Oy | Finland |
| NB 2265 | 3EC International a.s. | Slovakia |
| NB 2797 | BSI Group The Netherlands B.V. | Netherlands |
| NB 2962 | QMD Services GmbH | Austria |
| NB 3018 | Sertio Oy | Finland |
IVDR公告机构
二、医疗器械法规背景
医疗器械法规MDR&IVDR于2017年5月发布,MDR取代了医疗器械指令MDD 93/42/EEC和植入式医疗器械指令AIMDD 90/385/EEC。IVDR体外诊断器械法规2017/746/EU取代了旧的体外诊断医疗器械指令98/79/EEC。上述法规于2021年5月26日执行。
三、医疗器械产品分类
MDR管辖范围内的医疗器械,按其风险大小可以分为四个等级:I类、IIa类、IIb类、III类,其中I类的风险最低,III类最高。这即是医疗器械的CE分类。
三、需要公告机构审评的产品
1、I类产品不需要NB(公告机构)审评,可以走符合性声明路径出口,找欧盟授权代表,编写MDR技术文档,完成产品检测,完成欧代所在国的备案/注册。
2、I类以上产品,包含I*(Is、Im、Ir)、IIa类、IIb类、III类产品,需要欧盟NB(公告机构)审评,审核ISO 13485质量管理体系和CE MDR技术文档,取得ISO 13485证书和CE证书。
五、公告机构情况汇总
1、共有39家公告机构根据欧盟MDR法规工作,地理分布如下:德国10家、意大利10家、荷兰3家、芬兰2家,波兰2家、西班牙、斯洛文尼亚、比利时、克罗地亚、法国、匈牙利、爱尔兰、挪威、捷克、斯洛伐克、塞浦路斯和瑞典各有一家。
2、有10家公告机构根据欧盟IVDR法规工作,地理分布如下:德国4家,荷兰2家,奥地利、法国、爱尔兰、斯洛伐克各1家。
四、选择公告机构
1、MDR/IVDR背景下如何选择欧盟NB(公告机构)
申请MDR/IVDR证书,一定选择有MDR/IVDR资质的公告机构,目前已有39家公告机构取得了MDR资质;10家公告机构取得了IVDR资质。其中,有9家机构同时拥有MDR和IVDR的审资质。
(1)MDD证书在有效期内的企业。如果需要申请MDR证书,可以先和原有的MDD公告机构进行沟通,沟通:周期、费用和审核要求,确定MDR认证推进时间表。企业与一直使用的公告机构进行合作可以很大程度降低沟通成本,加快MDR的的认证进度。如原有机构已放弃MDR的审核资质申请,企业可根据实际需求及时选择新的公告机构。需要注意的是。2024年5月27号起,企业持有的MDD指令的CE证书将全部失效。
(2)MDD证书已过期或新的企业,申请MDR证书。可以把产品资料发给公告机构,沟通是否接单。
2、在接单的前提下,企业可以综合对比公告机构的品牌知名度、认证费用和项目周期;根据实际需求,确定合作的机构。
(1)品牌知名度:欧盟已认定了数十家认证机构,如挪威的DNV、德国的TUV、英国的BSI和法国BVQI等都是知名度较高的认证机构。
(2)认证费用:
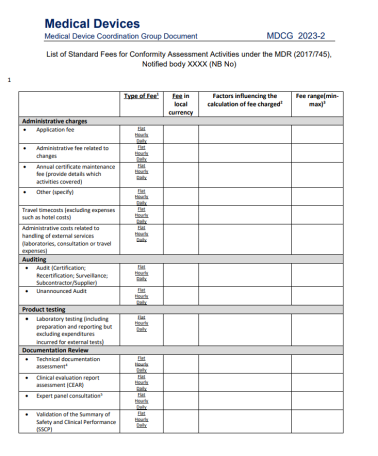
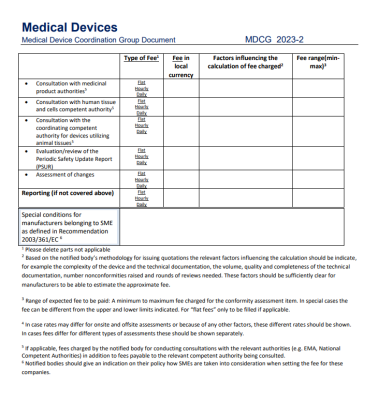
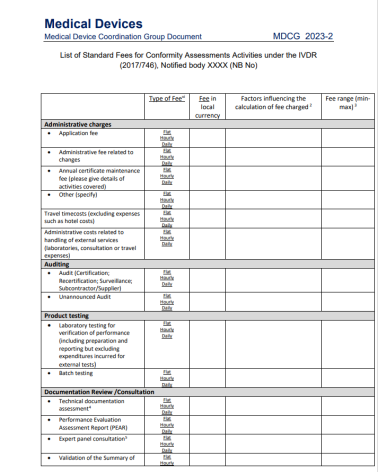
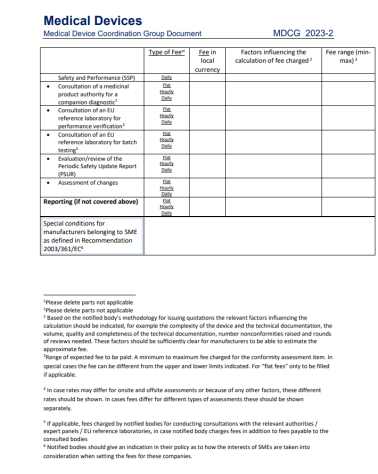
在2023年初,标准费用清单的MDCG2023-2出台。关于认证费用MDR认证和IVDR认证中均有条款规定:“公告机构应建立其开展的符合性评估活动的标准费用清单,并应将这些清单公之于众。”本指导文件中提供的标准费用清单模板旨在帮助公告机构根据MDR第50条和IVDR第46条确定其公布费用清单。虽然公告机构可以自由选择其价格,但必须公开透明。在公告机构公布的正常费用清单中,项目也应非常明确。所有属于NB(公告机构)指定范围内的定期提供的活动和合格评定活动应始终包含在公布的价目表中。
①“固定收费”:即不以所需的时间和资源而定,但应充分以实际发生的成本为基础的固定收费。
②“按时间收费”:即按分配给活动的时间收费。
公告机构应就每项收费项目注明收费类别,即是固定收费还是按时间收费。除了这些费用外,合理的外部费用也应作为支出申报(例如差旅费、外部测试费用)。如果费用取决于时间以外的因素,则应明确说明。如果没有办法写明详细费用,公告机构可以给出预期费用区间(每个费用项目的最小值和最大值),并写明会影响到支付的费用的因素。
总的来说,对于所示每个项目,这些因素应考虑到各自合格评定活动的总体成本的粗略估计。
具体如下:
原文地址:https://health.ec.europa.eu/system/files/2023-01/mdcg_2023-2_en.pdf
这份文件能帮助医疗器械制造商能够更准确地评估MDR、IVDR法规下的CE标识认证的成本,有助于中小企业对于相关的认证流程制订更加清晰的计划。
(3)项目周期:筹备项目至获得证书预计12个月左右(常规产品不含临床,IIb植入及III周期更长)
(4)公告机构的其他因素:
①医疗器械认证方面的经验
②所熟悉的医疗器械的范围
③拥有的专业特长,如电磁兼容、软件等
④被授权的医疗器械认证范围
⑤被授权的可进行的符合性评价程序
⑥机构地点及工作语言
五、 证书效期
MDR下,CE证书的效期由NB(公告机构)根据企业情况决定,而不是固定的五年。

