俄罗斯医疗器械注册流程
一、RZN介绍
Federal Service for Surveillance in Healthcare (Roszdravnadzor), RZN
二、适用法规
第1416号决议“State Registration of Medical Devices”及后续发布的补充决议
第2N号法令“Technical Trials, Toxicological Studies and Clinical Trials”
第4N号法令“Medical Devices Nomenclature Classification”
第7N号法令“Import of Medical Products”
第11N号法令“Technical Files and Operation Manual”
三、医疗器械分类
Class I, IIa, IIb, III(风险等级由低到高)
四、RZN认证资料
证书类:CE,ISO,PoA, WIPO(在俄注册商标证书),DoC;
技术文件类:STED,产品描述,检测报告(当地的理化和毒理测试),IFU,标签,原材料信息,包装信息,验证报告,生产过程,彩页,生物学报告,CER,临床试验报告,RMR,产品实物图等
五、体系考核
一阶段:
检查技术文档,以确保器械相关信息的安全性和有效性;
由专家组织在不超过20个工作日的时间内进行质量、效率和安全方面的检查;
检查结束后,就进行临床试验的可能性得出结论。(针对风险等级为Ⅱa、Ⅱb和Ⅲ的医疗器械)
证实临床数据:
进行临床试验;
提交临床数据。(在一阶段文件入审时,RZN会告知进行现场体系审核)
二阶段:
在不超过10个工作日的时间内审查临床数据;
考察结束后,将决定是否颁发注册证书。
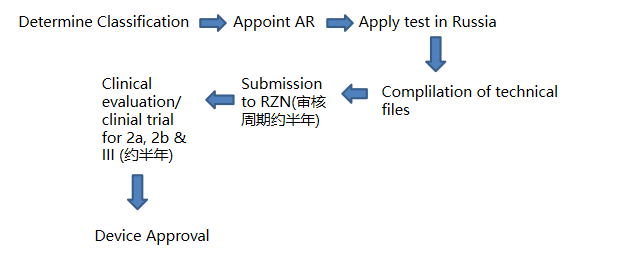
六、RZN医疗器械注册流程
1. 确定医疗器械产品所属的分类,并根据医疗器械命名编码系统确定医疗器械的分类编码;
2. 指定俄罗斯授权代表,签订协议;
3. 俄罗斯授权代表向RZN申请样品进口许可证;
4. 对样品开展临床前测试,包括但不限于:毒理、安规、电磁兼容等;(测试机构必须是得到RZN认可的实验室)
5. 俄罗斯授权代表向RZN提交技术文档。完整的技术和说明文档必须包括风险管理文件。