新加坡医疗器械注册流程
一、HSA介绍
在新加坡,医疗器械是由新加坡卫生科学局(HSA)的医疗器械分部负责监管的。 新加坡是东盟(ASEAN)成员国之一,其监管系统以2007年卫生产品法令与2010年卫生产品(医疗器械)规定为基础。
在新加坡进口、分销或销售任何医疗器械、化妆品、食品、保健品之前,它们必须在卫生科学局 (HSA) 进行注册。只有当地注册公司的许可证持有人或注册人才能提交医疗器械注册。新加坡 HSA 遵循 GHTF 医疗器械分类指南。
二、适用法规
1、Health·Products·Act·2007.
2、Health·Products·(Medical.Devices)·Regulations·2010.
3、GN-15-R9·guidance on medical·device product registration
三、医疗器械分类
医疗器械在新加坡被分为四个风险等级,制造商必须根据其预期用途将每个医疗器械进行分类。A类的风险等级最低,D 类则风险等级最高。
类别 | 风险级别 | 器械例子 |
A | 低 | 压舌板,玻璃液体温度计,医用口罩,听诊器,助行器… |
B | 中偏低 | 皮下注射针头,麻醉呼吸回路,助听器… |
C | 中偏高 | 呼吸机,骨科植入物品,婴儿保温箱,采血袋,除颤器… |
D | 高 | 心脏起搏器,植入式除颤器,植入式输液泵,心脏瓣膜,子宫内避孕器械,神经导管… |
四、HSA认证资料
新加坡卫生科学局(HSA)注册申请提交资料或技术文件是基于东盟CSDT(普通提交材料格式)文件格式的。所提交的材料中要求的信息取决于您的医疗器械分类以及所选择的评估路径。来自欧盟技术文件的文件资料多半是可以用来满足许多佐证文件资料要求的。
QMS:需要提供QMS证明
标签:标签必须是英文的;同时,HSA正在逐步推行UDI,从高风险Class D 开始实施
标准:HAS承认各种国际区域国家标准
临床数据:每个医疗器械都需要适合该设备用途和分类的临床数据,HSA可以接受其他国家的临床数据
五、体系考核
在新加坡没有经营场所的法定制造商必须指定一名当地代表,即注册人,这个注册人可以作为一个法人、组织或者公司,向HSA提交注册申请。注册人必须是有一家在HSA注册的新加坡公司,并持有ACRA证书。注册人不需要HSA的许可证,但必须在Medical Device Information Communication System中注册。
所有的医疗器械必须由注册人提交,注册人进行提交并负责上市后的一些活动。
注册人还需要监管控制制造商在新加坡的授权进口名单,如果注册人是独立第三方,需要对分销商或者进口商进行授权才能完成整个闭环的工作。
对于同一个设备可以由多个注册人进行注册。如果企业和前一位注册人关系破裂,除非之前的注册人愿意转移证书,否则必须重新进行注册。
六、HSA医疗器械注册流程
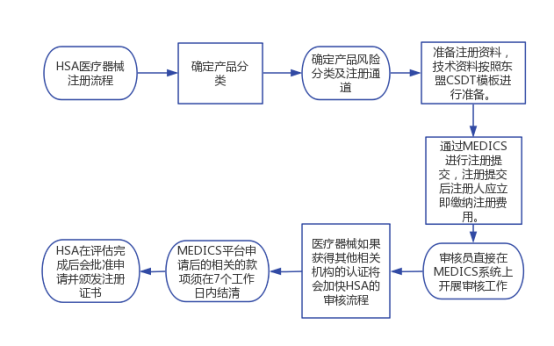
1、确定产品分类
根据HSA发布的《gn-14-r3 guidance on the risk classification of in vitro diagnostic md》分类规则确定注册产品的分类。
Class A类的器械免于注册审核,但此类医疗器械在所投放新加坡市场之前应当遵守法规中所有相关医疗器械安全和性能的规定。并且需当地代表/经销商通过MEDICS将产品列入卫生科学局(HSA)的A类医疗器械数据库中。
Class B、Class C和Class D类产品均需要进行产品注册。
2、准备注册资料
新加坡的医疗器械和体外诊断试剂产品注册的资料除了行政文件如新加坡授权代表的Establishment Licensing和授权书letter of authorisation以外,技术资料按照东盟CSDT模板进行准备。
东盟(CSDT)格式清单:
(1)执行摘要
(2)基本原则清单
(3)符合性声明
(4)设备描述
(5)设计验证和确认文件的详细信息:
①临床前研究的完整报告,例如物理测试数据、生物相容性研究、动物研究以及软件验证和确认研究
②计量要求(如适用)
③灭菌验证(如适用)
④保质期研究和预计使用寿命
(6)临床评估报告,包括所引用研究的出版物和完整报告
(7)设备标签
(8)风险分析
(9)生产和灭菌场所的名称和地址
(10)以下至少一项质量管理体系的证明:
①ISO 13485质量管理体系证书
②符合美国FDA质量体系QS820的证明
③符合日本厚生劳动省条例的GMP证书
(11)生产过程——工艺流程图
3、注册提交
所有医疗器械和体外诊断试剂的注册必须由注册人通过医疗器械信息和通信系统(MEDICS)在线提交。
注册提交后注册人应立即缴纳注册费用。
HSA在收到注册申请后,审核员会直接在MEDICS系统上开展审核工作,并会通过MEDICS系统回复相应的信息,比如要求进一步提供补充文件或说明。所有通信均通过 MEDICS 系统进行,该系统会自动向注册人(新加坡授权代表)发送电子邮件消息。
对于符合要求的注册申请,HSA在评估完成后会批准申请并颁发注册证书,通知注册人。对于不符合要求的,HSA会驳回注册申请。
4、加速审批流程
医疗器械如果获得美国(FDA)、欧洲(EU NB)、澳大利亚(TGA)、日本(MHLW)或 加拿大(HC)相关机构的认证将会加快卫生科学局(HSA)的审核流程。
5、官方的注册费用
所有提交的医疗器械申请,又或是后期的变更都需要相对应的费用。
卫生科学局会在收到MEDICS平台的申请后自动生成费用发票。其相关的款项须在7个工作日内结清。无论出于何种原因,如果未在截止日期内结清款项,则将视为过期申请,且需要重新提交。