NMPA认证流程
一、NMPA介绍
NMPA是国家药品监督管理局National Medical Products Administration的简称。国家药监局是唯一负责进口医疗器械审批和注册的机构。
二、适用法规
《医疗器械监督管理条例》
《医疗器械注册与备案管理办法》
《体外诊断试剂注册与备案管理办法》
三、医疗器械分类
NMPA认证分为一类、二类和三类医疗器械认证,根据医疗器械的风险级别进行分类。其中,一类医疗器械只需进行备案,二类和三类医疗器械需要进行更严格的认证流程,包括技术评价、质量管理体系审核和临床试验(对三类医疗器械)等步骤。
四、NMPA认证资料
医疗器械产品注册申报包括“注册申报”、“变更注册申报”、“延续注册申报”三种。
《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2021年第121号)《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(2021年第122号)给出了三种注册申报需要提交的资料要求。
注册申报资料的具体技术要求,还可参考适用的指导原则、审评要点。
五、体系考核
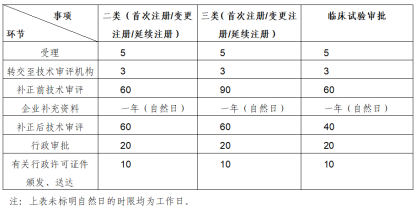
注册申报所需时长(来源:药监局器审中心)
NMPA根据设备的复杂性、使用情况和风险产品分为三类,一类医疗器械审批通常需要6-9个月将直接做出决定的一次提交就足够审批,而II类医疗器械审批需要10-12个月;III类医疗器械的批准通常需要12-18个月甚至更长时间,Ⅱ类和Ⅲ类产品需要NMPA下属的“医疗器械评估中心(CMDE)”进行技术审查,由NMPA认证的测试人员或测试实验室进行型式测试。
六、NMPA医疗器械注册流程
1. 准备工作:准备相关的技术文件和申请材料,包括产品技术规格、临床试验数据(如果适用)、质量管理体系文件等。
2. 选择认证机构:选择合格的NMPA认可的认证机构,提交申请并缴纳相应的认证费用。
3. 技术评价和审核:认证机构对申请材料进行技术评价和审核,确保医疗器械的设计和性能符合相关技术标准和法规要求。
4. 质量管理体系审核:认证机构对申请人的质量管理体系进行审核,确保产品的生产过程受到有效控制,符合质量管理要求。
5. 临床试验(对三类医疗器械):如果申请的是三类医疗器械,可能需要进行临床试验,验证其安全性和有效性。
6. 提交报告和建议:认证机构将审核结果和认证建议提交给NMPA。
7. NMPA审定:NMPA对审核报告进行审定,确认认证是否符合相关法规和政策。
8. 颁发认证证书:如果认证通过,认证机构将向申请人颁发医疗器械NMPA认证证书,确认医疗器械符合中国国家的质量与安全标准,可以在中国市场上销售和使用。
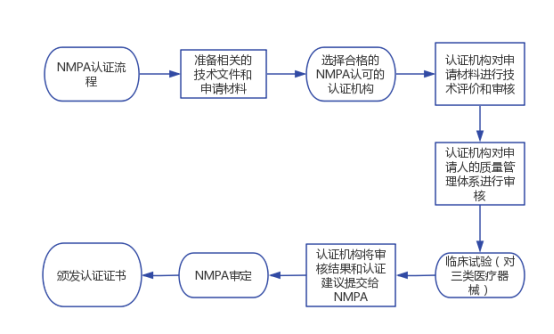
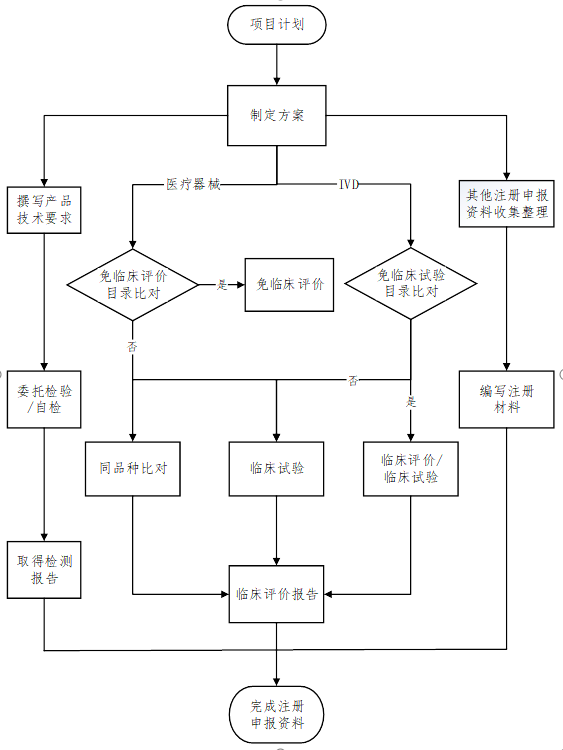
(来源:药监局器审中心)

